10)
ქიმიური ნაერთების ფორმულის შედგენა
|
ქიმიური ფორმულა: ინდივიდუალურ ნივთიერებათა შედგენილობის გამოსახულება ქიმიური ნიშნებისა და რიცხვების საშუალებით. ზოგად შემთხვევაში გამოისახება როგორც აyბxგz. სადაც ა, ბ, გ არის ქიმიურ ელემენტთა სიმბოლოები (Na, O, Fe, Cl და ა.შ.) რომელთაგან შედგება მოცემული ნივთიერება, ხოლო x, y, z მთელი რიცხვებია, რომლებიც გვიჩვენებენ მოლეკულაში შემავალი ცალკეული ატომების რაოდენობას. საგულისხმოა, რომ ქიმიურ ფორმულებში რიცხვი 1 არ იწერება და ის უგულველყოფილია. |
 |
ქიმიური ელემენტების კომბინირებით მიიღებიან ნაერთები ძირითადი პრინციპით:
აx+ + ბ-y → აyბx (სქემა 1)
❶ ნაერთის ფორმულის ელემენტ „ა“-ს როლში გამოდის ის, რომელიც პერიოდულ სისტემაში მეორესთან შედარებით უფრო მარცხნივ არის განლაგებული.
| მაგალითისათვის: Li და F დაწყვილებისას. პერიოდულ სისტემაში Li-ის პოზიცია უფრო მარცხნივ არის ვიდრე F-ს, მათი შეერთებით მისაღები ფორმულის სწორ ჩანაწერში „ა“-ს როლში გამოდის Li (ლითიუმი), ხოლო „ბ“-ს როლში იქნება პერიოდულ სისტემაში უფრო მარჯვნივ განლაგებული ელემენტი F (ფტორი). |
❷
ელემენტების შესაბამისი ჟანგვის ხარისხი
x+ და y-
იძებნება პერიოდულ სისტემაში მოცემული ელემენტის უჯრაში.
მოძიებისას მიაქციეთ ყურადღება
'+' და
'—' მუხტებს. „ა“-ს როლში გამოსული
ელემენტისათვის ყოველთვის შეირჩევა ჟანგვის ხარისხი + ნიშნით, ხოლო „ბ“-ს
კი უარყოფითი - ნიშნით.
❸ ელემენტების დაკავშირებისას მათი სიმბოლოების ინდექსები (x და y) იწერებიან კონკრეტული ციფრების სახით და მათ წარმოადგენს მეწყვილე ელემენტის ჟანგვის ხარისხი (იხ. დასაწყისში სქემა 1.) მაგალითად:
| P5+ + O2- → P2O5 | V5+ + C4- → V4C5 |
| Al3+ + S2- → Al2S3 | Cl7+ + O2- → Cl2O7 |
❹ საყურადღებოა, რომ თუ ჟანგვის ხარისხი ერთის ტოლია ის ციფრების სახით არ აღინიშნება (წერისას და კითხვისას იგულისხმება, რომ ერთია).
| გამოსახვის ფორმატი | |
| სწორი | არასწორი |
| K+ + N3- → K3N | K1+ + N3- → K3N1 |
| Si4+ + F- → SiF4 | Si4+ + F1- → Si1F4 |
| Na+ + C4- → Na4C | Na1+ + C4- → Na4C1 |
❺
ასევე, თუ ელემენტების ინდექსები ერთმანეთზე იყოფიან, მაშინ ორივე
ინდექსი იყოფა მათგან უმცირესზე. მაგალითად:
S4+
+ O2-
→
S2O4
ინდექსები 4 და 2 ერთმანეთზე იყოფა (არიან ჯერადები).
შესაბამისად შემდგომ უნდა მოხდეს მათი გაყოფა
უმცირესზე, ანუ ამ შემთხვევაში 2-ზე. მაშასადამე საბოლოო ფორმულა იქნება
არა S2O4
არამედ SO2.
ამგვარად:
Mg2+
+ Si4-
→
არ დარჩება, როგორც Mg4Si2.
რადგანაც მოცემული ინდექსები 4 და 2 ერთმანეთზე
იყოფიან და ფორმულაში გამოდის 2 და 1 შესაბამისად საბოლოო
ფორმულა გამოდის, როგორც Mg2Si.
იგივენაირად W6+
+ O2-
→
არა W2O6
არამედ
WO3-ია
ვინაიდან ინდექსები 6 და 2 ერთმანეთზე
იყოფიან.
11) ლითონთა და არალითონთა ოქსიდების ქიმიური თვისებები.
|
ოქსიდები: ქიმიური ელემენტის ჟანგბადთან ნაერთს ოქსიდი ეწოდება. ოქსიდები მხოლოდ ორი ელემენტისაგან შემდგარი ნაერთებია, რომელთაგანაც ერთ-ერთი ჟანგბადია. ოქსიდებში ჟანგბადი ყოველთვის ავლენს 2- ჟანგვის ხარისხს. |
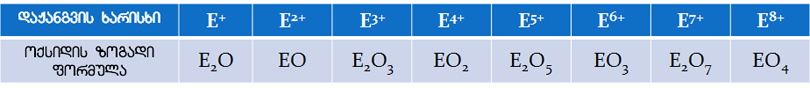 |
| ნახ 1. ელემენტთა ოქსიდების ზოგადი ფორმულები. E სიმბოლოთი აღინიშნება ნებისმიერი ელემენტი. |
ატომების მიერ ელექტრონების მიმართ განსხვავებული სწრაფვა უთუოდ ისახება მათგან შემდგარი ნივთიერებების ქიმიურ თვისებებზე. როგორც ჩვენთვის ცნობილია, ელექტრონების მიმართ მაღალი ლტოლვის მქონე (ელექტრონების ამრთმევი, დამჟავნგველი) ატომები წარმოადგენენ არალითონებს, ხოლო ელექტრონების გამცემ ატომებს წარმოადგენენ ლითონები, აღმდგენელები. გასულ კვირას გარჩეულ იქნა ლითონთა და არალითონთა ქიმიური თვისებები, რომლებიც როგორც ირკვევა გააჩნიათ ურთიერთგამომრიცხავი/ურთიერთშემავსებელი ხასიათი (ვისაც გახსენება სჭირდება იხ. ბმული კვირა 2/ნახ. 3). როგორც თქვენ სავარაუდოდ ხვდებით, ანალოგიური სურათი ვრცელდება მათგან წარმოქმნილ ნივთიერებებზეც. ლითონებისა და არალითონების ნაერთებს ასევე გააჩნიათ თვისებათა ამგვარი პოლარობა.
რაც შეეხებათ თავად ოქსიდებს, აქ აღსანიშნავია:
|
ოქსიდების ქიმიური თვისებები: • ლითონთა ოქსიდებს გააჩნიათ ფუძე თვისებები და წყალთან ურთიერთქმედების შემთხვევაში იძლევიან ფუძეებს; • არალითონთა ოქსიდებს გააჩნიათ მჟავა თვისებები და წყალთან ურთიერთქმედების შემთხვევაში იძლევიან მჟავებს. |
ამასთან დამატებით კიდევ ორი თვისებაც:
• ლითონთა და არალითონთა ოქსიდების ურთიერთქმედების
შედეგად მიიღებიან მარილები;
• ლითონთა ოქსიდები ურთიერთქმედებენ მჟავებთან, ხოლო
არალითონების - ფუძეებთან.